Przegląd Mleczarski 5/2025 – Fizykochemiczne czynniki kształtujące stabilność termiczną preparatów białek mleka

Świeże mleko o naturalnym pH (6,5-6,7) można podgrzewać w temperaturze 140°C przez ponad 10 minut, zanim nastąpi koagulacja, ale gdy pH ulega zmianie, stabilność termiczna ulega obniżeniu. Koagulacja cieplna mleka jest wynikiem agregacji białek mleka. Dodanie lub usunięcie minerałów, takich jak wapń i fosfor, silnie wpływa na stabilność termiczną białek mleka, podobnie jak ilość naturalnie występującego mocznika czy degradacja laktozy [3].
Mleko, niezależnie od jego ostatecznego przeznaczenia technologicznego, jest poddawane przynajmniej jednej obróbce cieplnej podczas cyklu produkcyjnego. Celem jej jest przede wszystkim zapewnienie bezpieczeństwa produktów, poprzez zniszczenie wegetatywnych form drobnoustrojów, w tym patogenów żywności oraz zapewnienie stabilności i ukierunkowanie transformacji składników surowca, np. interakcje białko-białko czy białko-cukier. W związku z tym parametry obróbki cieplnej są bardzo różne, od łagodnych (termizacja 57-68°C przez 15 s) do bardzo wysokich (sterylizacja 110-120°C przez 10-15 min; ultrapasteryzacja momentalna – UHT 135-150°C przez 1-10 s). Świeże mleko o typowym składzie chemicznym ma wysoką stabilność termiczną, głównie ze względu na słabo zdefiniowaną trzeciorzędową strukturę kazeiny [8, 11, 12], aczkolwiek oporność cieplna poszczególnych białek i preparatów jest dość zróżnicowana.Białka mleka
Białka mleka to heterogeniczna grupa cząsteczek, które dzieli się na pięć głównych frakcji: kazeiny, białka serwatkowe, białka otoczek kuleczek tłuszczu mlekowego, enzymy i inne związki białkowe występujące w mleku w śladowych ilościach. Czynnikami różnicującymi jest zawartość i proporcje między poszczególnymi białkami, ich pochodzenie, różnorodność funkcji, obecność homologów, metody izolacji, struktura molekularna, a także stopień ich modyfikacji. Heterogeniczność białek mleka jest dodatkowo bardziej złożona przez obecność wariantów genetycznych. W mleku występują cztery główne frakcje kazeiny (αs1-, αs2-, β-, κ-) oraz cztery główne grupy białek serwatkowych (β-laktoglobuliny, α-laktoalbuminy, albuminy surowicy bydlęcej – BSA, immunoglobuliny). Frakcjonowanie i izolacja składników białkowych zależą od właściwości fizykochemicznych poszczególnych białek. Niektóre proteiny mają tendencję do samoistnego łączenia się lub tworzenia połączeń/kompleksów z innymi białkami [1, 4, 8].
Stabilność termiczna białek mleka
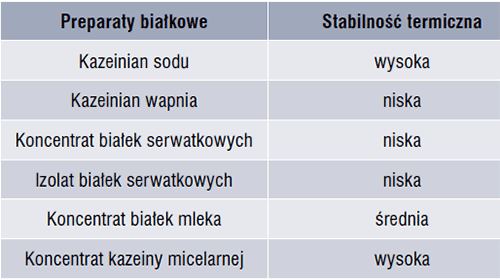
Stabilność cieplna białek mleka lub jej brak jest ważną właściwością funkcjonalną, która powinna być rozważana podczas ich dodatku do produktów spożywczych. Białka mleka oraz uzyskane z nich preparaty różnią się podatnością na agregację i wytrącanie indukowane przez wysoką temperaturę (tab. 1). Micele kazeiny w mleku i wodnych roztworach kazeinianu sodu są wyjątkowo stabilne cieplnie; 3% roztwór kazeinianu sodu o pH 7 można ogrzewać w temperaturze 140°C przez 60 min bez oznak koagulacji, podczas gdy mleko odtłuszczone jest zwykle stabilne w temperaturze 140°C przez ok. 15-20 min przy pH 6,7. Kazeinian wapnia, zawierający 1,5% Ca, cechuje niska termostabilność, a jego agregacja i koagulacja występują już w temperaturach powyżej 45°C [4, 8]. Kazeina micelarna jest stabilna termicznie. Stwierdzono [9], że wyższa stabilność koncentratu kazeiny micelarnej (MCC) koresponduje ze zwiększonym pH roztworu. Preparat MCC poddany obróbce cieplnej w temperaturze od 110°C do 150°C przez 52 s, przy pH < 6,7; ulegał koagulacji, podczas gdy przy pH > 6,9 nie zaobserwowano zwiększenia wielkości cząstek białek i istotnych zmian po obróbce cieplnej.
Tabela 1. Stabilność termiczna preparatów białkowych [8, 9]
Białka serwatkowe łatwo denaturują w temperaturze powyżej 70°C, co prowadzi do ich agregacji i wytrącania. Podatność białek serwatkowych na denaturację termiczną zależy od pH, całkowitej zawartości suchej masy, stężenia jonów wapnia, obecności cukrów i środków modyfikujących białko. Stabilność termiczna poszczególnych białek serum jest zróżnicowana (rys. 1), a ich szereg termostabilności przedstawia się w następującej kolejności: immunoglobuliny < BSA < β-laktoglobulina < a-laktoalbumina [4, 8].
Rysunek 1. Wpływ ogrzewania mleka, przez 30 min w różnych temperaturach, na zawartość rozpuszczalnych form białek serum (oznaczenie po ochłodzeniu i zakwaszeniu do pH = 4,6)
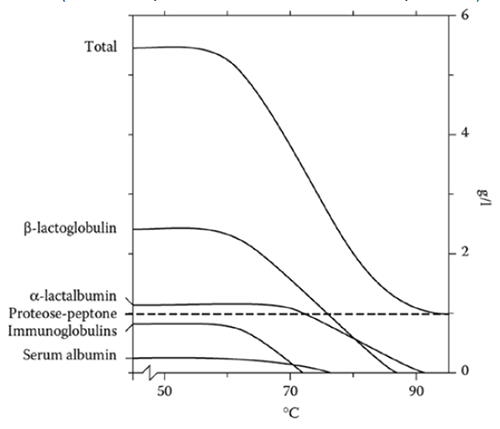
Gdzie:
na osi x – temperatura obróbki termicznej,
na osi y – rodzaj białek serwatkowych oraz ich zawartość [g/l]
Źródło [8]
Ocena stabilności termicznej
Stabilność termiczna mleka/roztworu, to zdolność do zachowania właściwości koloidalnych, w szczególności białek, podczas działania wysokiej temperatury, bez widocznych zmian w postaci koagulacji lub żelowania. Najpowszechniej stosowana metoda oceny stabilności cieplnej – test subiektywny White’a Davies’a, polega na ogrzewaniu próbki mleka w szklanej probówce, umieszczonej w łaźni olejowej o kontrolowanej temperaturze (140°C w przypadku mleka surowego i 120°C w przypadku mleka zagęszczonego) [9]. Aby określić stabilność termiczną preparatów białkowych, należy ocenić jak roztwór białka (5%) reaguje na obróbkę termiczną w warunkach 121°C przez 15 min [7]. Czas koagulacji cieplnej (z ang. Heat Coagulation Time – HCT) jest definiowany jako czas, który upływa od umieszczenia próbki mleka w łaźni olejowej do rozpoczęcia koagulacji widocznej jako drobne skłaczenia w roztworze [10, 12].
Inne metody oceny stabilności termicznej obejmują próby etanolowe, test sedymentacji białka czy określanie zmian lepkości w mleku ogrzewanym [10].
Czynniki wpływające na stabilność termiczną
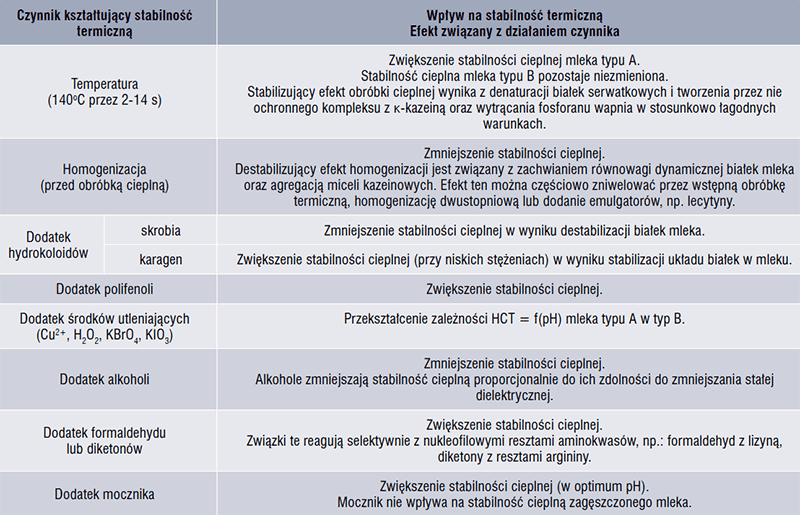
Szereg czynników kształtuje stabilność termiczną mleka i preparatów białkowych z mleka (tab. 2). Głównym czynnikiem wpływającym na wzrost stabilności cieplnej jest zmniejszenie aktywności jonów wapnia. Obniżenie stabilności termicznej mleka jest spowodowane głównie: obniżeniem pH, osadzaniem fosforanu wapnia na micelach kazeiny, defosforylacją kazeiny, dysocjacją i hydrolizą kazeiny, w szczególności κ-kazeiny, zmniejszeniem potencjału zeta i hydratacji białek, tworzeniem wiązań kowalencyjnych oraz wiązaniem białek serwatkowych z micelami kazeiny [10].
Jednym z najważniejszych czynników wpływających na HCT jest pH. Wzrost kwasowości mleka powoduje obniżenie stabilności cieplnej mleka – przy pH ok. 6,2 denaturacja kazeiny następuje już w temperaturze poniżej 100°C. Ze względu na przebieg zależności HCT w funkcji pH – HCT = f(pH) – wyróżnia się dwa typy mleka: A i B. Dla mleka klasyfikowanego jako typ A, w zakresie pH od 6,4 do 7,2; pośredni punkt maksimum HCT obserwuje się przy wartościach pH ok. 6,7; zaś minimum stabilności przy pH ok. 6,9; a dalsza alkalizacja odczynu skutkuje wzrostem termostabilności (rys. 2). W przypadku mleka klasyfikowanego jako typ B (rys. 2), czas koagulacji cieplnej wzrasta w funkcji pH, będąc niższym w obszarze pośredniego maksimum oraz wyższym w regionie minimum aniżeli w przypadku mleka typu A. Z kolei HCT mleka zagęszczonego (20% s.m.b.) jest znacznie krótszy niż mleka niezagęszczonego, przy czym maksimum występuje w zakresie pH 6,4-6,6 (rys. 2) [8, 10, 12].
Rysunek 2. Zależność czasu koagulacji cieplnej od pH niezagęszczonego mleka typu A i B oraz mleka zagęszczonego
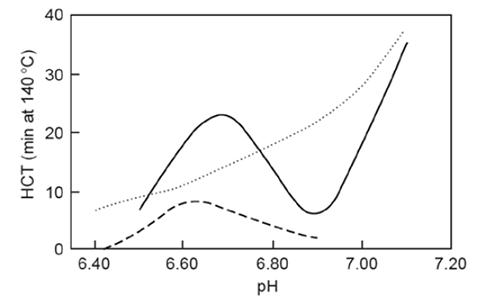
Gdzie:
–- niezagęszczone mleko typu A
··· niezagęszczone mleko typu B
- - mleko zagęszczone
Źródło [8]
Modyfikacja składu soli mineralnych w mleku wpływa na przebieg zależności HCT = f(pH). Stosunkowo niewielkie zmniejszenie (15%) stężenia jonów wapnia (Ca2+) i magnezu (Mg2+) zwiększa stabilność termiczną w zakresie pH 6,5-7,5; podczas gdy dodanie jonów Ca2+ i Mg2+ destabilizuje koloidalny układ białek w całym przedziale wartości pH. Dodatek fosforanów zwiększa stabilność termiczną mleka, ze względu na ich zdolność do chelatowania wapnia, podczas gdy redukcja ilości rozpuszczalnego fosforanu powoduje przesunięcie funkcji HCT = f(pH), w kierunku bardziej zasadowych wartości pH. Również fortyfikacja poziomu cytrynianów zwiększa stabilność termiczną mleka, ze względu na ich zdolność do wiązania wapnia jonowego i tworzenia z nim rozpuszczalnych związków kompleksowych, a ponadto ich wpływu na dysagregację micel kazeiny na skutek odłączania od nich fosforanu wapnia. Usunięcie 40% koloidalnego fosforanu wapnia (CCP) wydłuża HCT mleka w zakresie pH 6,4-7,4; podczas gdy usunięcie 60-100% CCP zwiększa stabilność cieplną w zakresie pH 6,4-7,0; ale ma destabilizujący wpływ przy wyższych wartościach pH [2, 7, 8].
Zwiększenie stężenia laktozy do około 150% jej normalnego poziomu powoduje destabilizację mleka w całym zakresie pH 6,4-7,4 i przesuwa funkcję HCT = f(pH) w stronę bardziej zasadowych wartości pH [10]. Usunięcie natywnej laktozy z mleka powoduje obniżenie jego stabilności termicznej, podczas gdy enzymatyczna hydroliza laktozy do glukozy i galaktozy zwiększa stabilność układu koloidalnego w całym zakresie pH [8].
Główny składnik niebiałkowego azotu w mleku – mocznik (150-250 mg/l), istotnie koreluje z jego stabilnością termiczną. Dodanie mocznika w ilości < 100 mg/100 ml poprawia stabilność cieplną mleka przy pH ok. 6,7. Natomiast dodatek mocznika > 200 mg/100 ml powoduje destabilizację fazy koloidalnej mleka w całym zakresie pH 6,4-7,2. Z kolei fortyfikacja poziomu mocznika w zagęszczonym mleku nie wpływa na zmianę przebiegu zależności HCT = f(pH). Warto zauważyć, że mocznik stabilizuje mleko tylko w obecności laktozy [6, 10, 12].
Spośród białek mleka, β-laktoglobulina i κ-kazeina mają największy wpływ na przebieg funkcji HCT = f(pH). Dodanie β-laktoglobuliny do mleka zagęszczonego działa destabilizująco w całym zakresie pH. Z kolei wzbogacenie mleka o κ-kazeinę zwiększa stabilność cieplną w obszarze pośredniego punktu minimum HCT i przekształca mleko typu A w mleko typu B (rys. 1). Dodatek αs2-kazeiny do mleka obniża jego stabilność termiczną, z uwagi na obecność w tej molekule 8 reszt o-fosforanowych, które wiążą wapń. Wysoki stosunek αs2- do β-kazeiny skutkuje wysoką stabilnością termiczną białkowego układu koloidalnego. Dodatek BSA destabilizuje mleko w całym zakresie pH [8].
W badaniach modelowych wykazano, że związki, takie jak formaldehyd, detergenty anionowe (np. dodecylosiarczan sodu) i kationowe (np. bromek cetylometyloamoniowy) zwiększają stabilność termiczną preparatów białkowych [10].
Naturalne ekstrakty bogate w polifenole, takie jak te pochodzące z kawy, herbaty, wina oraz liści i kory dębu, dodane do mleka wykazują zdolność do zwiększania jego stabilności cieplnej. Spośród nich kwas 3,4-dihydroksycynamonowy, występujący w kawie, szczególnie wyróżnia się skutecznością w poprawie stabilności cieplnej mleka [10].
Tabela 2. Wpływ procesów jednostkowych i dodatków do żywności na stabilność termiczną mleka i preparatów na bazie białek mleka [4, 8]
Białka serwatkowe i kazeina a stabilność termiczna
Białka serwatkowe łatwo ulegają denaturacji pod wpływem obróbki cieplnej w temperaturze powyżej 70°C, przy czym reagują ze sobą lub z micelami kazeinowymi. Frakcja – κ-kazeina na powierzchni miceli kazeiny bierze udział w tworzeniu specyficznego kompleksu połączonego wiązaniami disulfidowymi z β-laktoglobuliną. Wartość pH podczas ogrzewania ma duży wpływ na zakres asocjacji białek serwatkowych z micelami kazeiny. Przy wartościach pH < 6,8; większość kompleksów białek serwatkowych pozostaje związana z powierzchnią micel kazeinowych, natomiast przy wyższych wartościach pH kompleksy te dysocjują i przechodzą do serum mleka. Podczas ogrzewania mleka przy wartościach pH > 6,8 nie tylko agregaty białek serwatkowych pozostają w serum mleka, ale także micelarna κ-kazeina dysocjuje do serum. Frakcje αs1- , αs2- i β-kazeina dysocjują z miceli po podgrzaniu, ale w znacznie mniejszym stopniu. Połączenie zdenaturowanych białek serwatkowych z micelami kazeinowymi zwiększa ich rozmiar i podnosi ich stabilność steryczną, w konsekwencji te micele są bardziej odporne na działanie czynników koagulujących, takich jak ogrzewanie, jony wapnia, etanol lub podpuszczka, aniżeli micele natywnej kazeiny [10, 12].
Białka mleka są szeroko stosowane do stabilizacji emulsji typu O/W (olej w wodzie). Flokulacja, jedna z głównych przyczyn niestabilności emulsji stabilizowanych białkiem, może prowadzić do przyspieszonego śmietankowania, wzrostu lepkości czy sedymentacji, co znacznie obniża jakość produktu. Jest to szczególnie ważne w technologii produktów takich jak: napoje zastępujące posiłek, napoje dla sportowców czy preparaty do początkowego żywienia niemowląt, które są zwykle sterylizowane w warunkach 120°C przez 5-10 min lub 140°C przez 3-5 s. Rodzaj aplikowanego białka w technologii tych produktów odgrywa kluczową rolę w kształtowaniu właściwości fizykochemicznych emulsji typu O/W. Ustalono, że emulsje stabilizowane kazeinianami są stosunkowo stabilne termicznie, podczas gdy emulsje stabilizowane białkami serwatkowymi, o tej samej zawartości protein, mają tendencję do agregacji/żelowania. Włączenie w formułę takiego produktu niewielkich ilości pojedynczych frakcji kazeiny, kazeiny micelarnej lub kazeinianów limituje termiczną agregację białek serwatkowych w roztworach tych napojów [5].
Praktyczne znaczenie stabilności termicznej
Zdolność białek mleka do zachowania stabilności, podczas obróbki w wysokich temperaturach, umożliwia wytwarzanie wielu produktów mleczarskich o ustabilizowanych właściwościach w czasie ich długiego przechowywania. Produkty te obejmują mleka i śmietanki UHT, sterylizowane mleka w puszkach, mleka zagęszczone, mleka w proszku, zwłaszcza te przeznaczone do procesów rekonstytucji i rekombinacji.
Z przemysłowego punktu widzenia, prawidłowo przeprowadzona selekcja surowca do procesu wysokotemperaturowego, sprawiała, że stabilność termiczna mleka stanowiła sporadyczny problem. Jednak w ostatnich latach na rynek wprowadzono wiele nowych produktów, takich jak: mleka wzbogacone wapniem, magnezem i cynkiem, ekstraktami kakao i herbaty, a także ze zmienionymi proporcjami białek. Ponieważ wiele z tych dodatków ma negatywny wpływ na stabilność termiczną, produkty te wymagają bardzo ostrożnej manipulacji ich recepturą, aby uzyskać optymalne właściwości funkcjonalne. Częstą trudnością jest osiągnięcie pożądanej stabilności przechowalniczej tych wyrobów [10, 11, 12].
Praktyczne rozwiązania problemów stabilności termicznej obejmują [10]:
- modyfikację parametrów obróbki cieplnej;
- dostosowanie naturalnego pH mleka/napoju mlecznego do pH maksymalnej stabilności termicznej;
- dodatek fosforanów.
mgr inż. Monika Małkowska – Kowalczyk
Katedra Mleczarstwa i Zarządzania Jakością
Wydział Nauki o Żywności
Uniwersytet Warmińsko-Mazurski w Olsztynie
dr inż. Maria Czerniewicz
Katedra Mleczarstwa i Zarządzania Jakością
Wydział Nauki o Żywności
Uniwersytet Warmińsko-Mazurski w Olsztynie
Dr hab. inż. Justyna Żulewska, prof. UWM
Katedra Mleczarstwa i Zarządzania Jakością
Wydział Nauki o Żywności
Uniwersytet Warmińsko-Mazurski w Olsztynie
Literatura
- Fox P.F., Guinee T.P. 2013. Cheese Science and Technology In: Milk and Dairy Products in Human Nutrition: Production, Composition and Health. Ed. Park Y.W. Haenlein G.F.W. D Sci. Ag. John Wiley&Sons.
- Fox P.F., Hoynes M.C.T. (1975). Heat stability of milk: influence of colloidal calcium phosphate and β-lactoglobulin. Journal of Dairy Research, 42(3), 427-435.
- Huppertz T. (2016). Heat stability of milk. Advanced dairy chemistry: volume 1B: proteins: applied aspects, 179-196.
- Kinsella J.E., Morr C.V. (1984). Milk proteins: physicochemical and functional properties. Critical Reviews in Food Science & Nutrition, 21(3), 197-262.
- Liang Y., Patel H., Matia-Merino L., Ye A., Golding M. (2013). Effect of pre-and post-heat treatments on the physicochemical, microstructural and rheological properties of milk protein concentrate-stabilised oil-in-water emulsions. International Dairy Journal, 32(2), 184-191.
- Rajput Y.S., Bhavadasan M.K., Singh A., Ganguli N.C. (1982). Heat stability of buffalo milk as affected by the addition of urea and glyceraldehyde. New Zealand Journal of Dairy Science and Technology, Vol. 17, No. 2, 185-190.
- Ramasubramanian L., D’Arcy B.R., Deeth H.C., Oh H.E. (2014). The rheological properties of calcium-induced milk gels. Journal of Food Engineering, 130, 45-51.
- Roginski H., Fuquay J.W., Fox P.F. (2002). Encyclopedia of dairy sciences. Volumes 1-4, 1321-1326
- Sauer A., Moraru C.I. (2012). Heat stability of micellar casein concentrates as affected by temperature and pH. Journal of dairy science, 95(11), 6339-6350.
- Singh H. (2004). Heat stability of milk. International journal of dairy technology, 57(2‐3), 111-119.
- TetraPak. 2013. Dairy Technology and Technology. TetraPak Sp. z o.o. Warsaw, 2013, 301-334.
- Walstra P., Wouters J.T.M, Geurts T.J. (2005). Dairy science and technology. Taylor & Francis Group, CRC Press.
















