Przegląd Mleczarski 2/2013 - Właściwości funkcjonalne kefiru

Już w początkowych latach XX wieku Ilja Miecznikow wykazał dobroczynny wpływ fermentowanego mleka na organizm ludzki, wywodząc z tego, tzw. długowieczność [6]. Aktualnie badania in vivo dotyczące właściwości prozdrowotnych mlecznych napojów fermentowanych wyraźnie poszerzają naszą wiedzę w tym zakresie, szczególnie w odniesieniu do ich wpływu na zdrowie ludzkie.
Już wcześniejsze badania wykazały, że mleczne napoje fermentowane mogą wykazywać właściwości probiotyczne, poprzez poprawę zdrowotności systemu trawiennego, redukcję cholesterolu, poprawę tolerancji laktozy i systemu odpornościowego oraz właściwości antykancerogennych. Spośród najbardziej znanych mikroorganizmów probiotycznych wymienia się Bifidobacterium species, L. acidophilus, L. planetarium, L. reuteri, L. rhamnosus, L. salivarius i Saccharomyces boulardii [30]. Kefir wyprodukowany z udziałem grzybków kefirowych zawiera naturalne probiotyki, głównie L. acidophilus, Bifidobacterium bifidum, dużą liczbę bakterii kwasu mlekowego i drożdży [6, 17].Parvez i wsp. [25] podają, że mikroorganizmy probiotyczne są najczęściej konsumowane z napojami fermentowanymi. Bioaktywne peptydy i białka z tych produktów, dostarczają ważnych dla zdrowia składników, które stymulują aktywność układu limfatycznego i wytwarzanie immunoglobulin, redukują nadciśnienie i wzrost absorpcji wapnia w jelicie [24].
Aktywność antymutagenną mleka fermentowanego opisano już dość dokładnie w odniesieniu do mikroorganizmów i wielu gatunków ssaków. Wykazano, że bakterie kwasu mlekowego charakteryzują się wysoką mutagennością [9, 13, 25].
Stidl i wsp. [34] badali zdolność bakterii kwasu mlekowego do redukcji heterocyklicznych amin powstałych podczas gotowania mięsa. Autorzy ci stwierdzili, że stopień redukcji zależał w dużym stopniu od rodzaju mikroorganizmu i w odniesieniu do L. helveticus, S. thermophilus, L. delbruecki subsp. bulgaricus, Bifidobacterium longum, L. casei, L. acidophilus, L. plantarum i L. kefir wynosił odpowiednio 83%, 68%, 59%, 44%, 42%, 20%, 10% i 9%. Nadathur i wsp., [25] używali, tzw. ”Ames test” z S. typhimurium TA 100 do badań antymutagennych różnych substancji chemicznych, ekstrahowanych z jogurtu acetonem. Autorzy ci stwierdzili efekty antymutagenne tych substancji, szczególnie w odniesieniu do 2,3-dimetylo-4-aminodwufenylu i N-metylo-N-nitro-N-nitroguanidyny, znanych już wcześniej jako potencjalnych związków mutagennych. Konsumpcja mlecznych napojów fermentowanych, zdaniem wielu autorów, hamuje wzrost różnych typów komórek rakowych u ludzi i zwierząt [2, 4, 21].
Kefir i grzybki kefirowe
Grzybki kefirowe zostały najwcześniej opisane w regionie gór północnego Kaukazu [36]. Kefir produkowano dzięki aktywnie fermentującym ”grzybkom kefirowym”, które zawierają dużą grupę bakterii kwasu mlekowego, drożdży i czasami bakterii kwasu octowego, rozmieszczonych w matrycach polisacharydowych, tworzących średnio twarde granule. Kiedy grzybki kefirowe są dodawane do mleka i inkubowane około 22 godzin w odpowiedniej temperaturze, mikroorganizmy w grzybkach kefirowych rozpoczynają fermentację oraz syntezę komponentów smakowo-zapachowych, co prowadzi w następstwie do zmian fizyko-chemicznych [6, 8]. Powstały kefir jest produktem lekko gazowanym, pokrzepiającym o unikalnym smaku i zapachu, zawierającym mieszaninę kwasu mlekowego, dwutlenku węgla, aldehydu octowego, acetony, małe ilości alkoholu i innych produktów zapachowych [8]. Cechą odróżniającą kefir od innych napojów fermentowanych jest to, że grzybki kefirowe są odzyskiwane po fermentacji. Biomasa grzybków kefirowych wolno wzrasta podczas kolejnego procesu fermentacji [6, 8].
Antymutagenne i antykancerogenne właściwości kefiru
Guzel-Seydim i wsp. [9] porównywali antymutagenną aktywność mleka, jogurtu i kefiru z użyciem ”Ames test”. Ekstrakt kefiru istotnie obniżał mutagenność metanosiarczanu metylu, azydku sodu i alfatoksyny B1, podczas gdy ekstrakty jogurtu i mleka wykazywały wyraźnie słabsze oddziaływanie. Guzel-Seydim i wsp. [9] stwierdzili, że w trzech izomerach CLA ([c9,t11], [t10,c12] i [t9,t11]), kwasy; masłowy, palmitynowy, palmitynoolejowy i olejowy występowały w wyższych ilościach w kefirze niż w jogurcie lub mleku. W dodatku izomery te charakteryzowały się wieloma korzystnymi właściwościami, m.in. antykancerogennymi i hipocholesterolemicznymi [10, 14]. Liu i wsp. [19] podają, że w kefirze i kefirze z mleka sojowego stwierdzono (”Amino testem”), istotną redukcję poziomu N-metylo-N-nitro-N-nitrosoguanidyny i 4-nitrochinoliny-N’-tlenku. Hamowanie w tym teście wynosiło odpowiednio 89,8% i 68,8%. 1,1-difenylo-2-pikrylo-hydrazyna, tj. aktywny zmiatacz wolnych rodników wyraźnie wzrastał pod koniec procesu fermentacji.
Shiomei i wsp. [32] podają, że efekty antyrakowe kefiru wiążą się z polisacharydami izolowanymi z grzybków kefirowych (w przybliżeniu o c.cz. 1000 kDa). Jak podają autorzy polisacharydy zawarte w kefirze hamują znacząco u mysz, wzrost komórek rakowych, w porównaniu do grupy zwierząt nie otrzymujących w diecie tego produktu. W innych badaniach stwierdzono również hamowanie komórek rakowych przez polisacharyd ”kefiran” [23, 30, 41]. W badaniach nad rozwojem raka piersi u mysz, de Moreno de LeBlanc i wsp. [4] stwierdzili podczas 27 dni doświadczenia, redukcję wzrostu komórek rakowych i wzrost IgA(+), kiedy zwierzęta otrzymywały okresowo pożywienie z kefirem i wolną frakcją komórek kefirowych. Rezultaty tych badań wskazują na bardzo ważne znaczenie wielu komponentów uwalnianych z mleka podczas fermentacji (rys. 1).
Rysunek 1. Schematyczny diagram właściwości funkcjonalnych kefiru
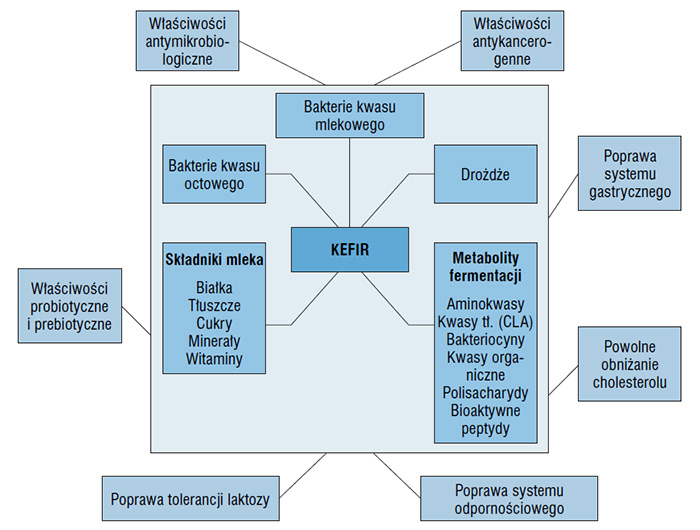
Źródło: Guzel-Seydium i wsp., [10]
Liu i wsp. [18] dowiedli, że zainfekowane wcześniej komórkami rakowymi myszy, karmione mlekiem odtworzonym z proszku, kefirem, mlekiem sojowym lub kefirem z mleka sojowego, wykazują dość wyraźne zróżnicowanie w hamowaniu rozwoju guza rakowego. Autorzy ci po dokładnej kontroli w 30 dniu eksperymentu stwierdzili, że rozmiary guza rakowego, w przypadku karmienia mlekiem odtworzonym z proszku wynosiły 2115 ± 901 mm3, kefirem 574 ± 335 mm3, mlekiem sojowym 1017 ± 770 mm3, kefirem z mleka sojowego 475 ± 292 mm3 a w grupie kontrolnej 1631 ± 753 mm3. Z powyższego wynika, że doustne podawanie kefiru z mleka lub mleka sojowego w istotny sposób hamowało wzrost komórek rakowych. Soja zawiera istotne składniki, z których dużą rolę odgrywają izoflawony. Związki te wpływają na zdrowie, hamując rozwój komórek rakowych i poprawę stanu kości [36]. Koncentracja tych związków w mleku sojowym i kefirze z mleka sojowego wynosi odpowiednio 47-50 μg/g. Jednakże autorzy konkludują, że hamowanie komórek rakowych nie musi być związane tylko z obecnością izoflawonów w mleku sojowym. W dodatku stwierdzono również wzrost poziomu IgA w jelicie cienkim.
Jednakże Hlastan-Ribić i wsp. [12] nie stwierdzili wpływu kefiru (o zawartości tłuszczu 1,1% i 3,5%) na hamowanie rozwoju komórek rakowych u szczurów rasy Wistar, wcześniej zainfekowanych tymi komórkami. Badania dotyczące ochronnego oddziaływania kefiru i wit. C u mysz, w odniesieniu do toksyczności azoksymetanu były prowadzone przez Sozmen i wsp. [38]. Autorzy ci stwierdzili, że związek ten powoduje uszkodzenie wątroby u mysz, a podawanie kefiru łagodzi ten stan. Cenesiz i wsp. [1] konkludują, że kefir charakteryzując się właściwościami antyoksydatywnymi, wpływa na łagodzenie tego oddziaływania. Autorzy ci stwierdzili, że poziom malonodialdehydu i tlenku azotu wzrastał wyraźniej w wątrobie, żołądku, śledzionie i okrężnicy zwierząt, którym podawano azoksymetan, a tylko nieznacznie w grupie otrzymujących azoksymetan i kefir.
Wpływ kefiru na cholesterol
Pozytywne efekty dotyczące metabolizmu i obniżenia cholesterolu w organizmie, przy spożywaniu głównie jogurtu, mają swoje uzasadnienie w kilku hipotezach próbujących wyjaśnić ten mechanizm [9, 19, 48]. Vujicic i wsp. [42] podają, że grzybki kefirowe pochodzące z różnych źródeł mogą asymilować i redukować cholesterol do 62% w mleku inkubowanym w 20°C przez 24 godziny lub do 84% w kefirze inkubowanym i przechowywanym w 10°C przez 48 godzin. Yoon i wsp. [44] podają, że cholesterol w 68,8% asymilowany jest w kefirze przez szczep L. acidophilus CU 673. Ci sami autorzy podają, że L. plantarum i L. paracasei oraz niektóre szczepy Bifidobacterium posiadają również zdolność asymilacji cholesterolu. Natomiast St Onge i wsp. [35] wykazali, że podawanie kefiru osobom cierpiącym na hipocholesterolemię nie powodowało obniżenia koncentracji lipidów w plazmie.
Urdaneta i wsp. [39] analizowali wpływ podawania kefiru na aktywność enzymów jelitowych, absorpcję cukru i masę ciała. Dwadzieścia samic szczurów rasy Wistar było karmionych dietą standardową z dodatkiem kefiru przez 22 dni. Autorzy ci stwierdzili wzrost aktywności dipeptydazy jelitowej, w grupie szczurów żywionych dietą z dodatkiem kefiru, co sugeruje poprawę strawności białka. Dodatek kefiru do diety nie powodował wzrostu masy ciała, wskaźnika masy ciała i masy narządów. Natomiast stwierdzono nieznaczny wzrost poziomu trójglicerolów, cholesterolu i HDL cholesterolu. Liu i wsp. [20] podają, że kefir i kefir z mleka sojowego obniżają poziom trójglicerydów w serum i poziom ogólnego cholesterolu u chomików. Gusen i wsp. [7] podają, że poziom malonodialdehydu w plazmie u mysz karmionych kefirem i jogurtem obniża się, co wskazuje, że mleczne napoje fermentowane wykazują właściwości ochronne zapobiegając tworzeniu się grup nadtlenkowych. Te przeciwstawne wyniki w oddziaływaniu kefiru na organizm mogą być spowodowane zróżnicowaniem grzybków kefirowych pochodzących z różnych źródeł. Yoshida i wsp. [45] podają, że substancje ścianek komórkowych Kluyveromyces marxianus YIT 8292, podobnie jak alfa-mannan i beta-glucan, wpływają na aktywność hipocholesterolemii u szczurów.
Inhibitory aktywności ACE (z angielskiego: angiotensyn converting enzyme) są obecne w kefirze. Aktywność ta jest spowodowana powstawaniem niskocząsteczkowych peptydów uwalnianych głównie z kazeiny [29]. Na szesnaście peptydów zidentyfikowanych z zastosowaniem chromatografii ekstrakcyjnej, dwa z nich (PYVRYL i LVYPFTGPPN) wykazywały aktywność inhibitującą aktywność ACE. Konsumpcja kefiran, zdaniem wielu autorów, istotnie obniża ciśnienie krwi. Stąd też aktywność ACE w serum i w aorcie szczurów była istotnie redukowana we wszystkich grupach zwierząt otrzymujących kefirany. Obserwowano również niższe poziomy ogólnego cholesterolu, LDH-cholesterolu i trójglicerydów.
Właściwości antymikrobiologiczne i antywirusowe
Kefir wykazuje działanie antybakteryjne w odniesieniu do wielu mikroorganizmów patogennych, co jest nierozłącznie związane z powstawaniem kwasów organicznych, nadtlenku wodoru, aldehydu octowego, dwutlenku węgla i bakteriocyn [28]. Dla przykładu bakteriocyny w kefirze o c.cz. 3,5 kDa były identyfikowane z L. plantarum ST8KF [28]. Antybakteryjne właściwości kefiru produkowanego z udziałem liofilizowanych handlowych kultur starterowych (PROBAT KC3, Danisco, Denmark) było badanych w odniesieniu do Staphylococcus aureus (ATCC 29213), Bacillus cereus (ATCC 11778), Salmonella enteritidis (ATCC 13076), Listeria monocytogenes (ATCC 7644) oraz Escherichia coli (ATCC 8739) i porównywane z ampicyliną i gentamycyną [38]. Antymikrobiologiczny efekt badano po 24 i 48 godzinach fermentacji i podczas 7 dni przechowywania chłodniczego. Uzyskano podobne strefy hamowania w próbach z antybiotykami i kefirem w odniesieniu do każdego patogenu. Dla przykładu strefa hamowania (średnica) dla E. coli wynosiła odpowiednio 19,1 mm, 18,6 mm, 20,2 mm i 20,8 mm dla 24 godz. kefiru, 48 godz. kefiru, ampicyliny i gentamycyny. Antymikrobiologiczna aktywność zależała bardziej od obecności w medium ampicyliny i gentamycyny niż od długości fermentacji i czasu chłodniczego przechowywania, jako istotnych parametrów technologicznych, wpływających na tę aktywność [38].
Santos i wsp. [31] badali właściwości probiotyczne Lactobacillus spp. izolowanych z kefiru. Zespół ten użył modelowych komórek Caco-2. Szczepy Lactobacillus spp. były testowane pod względem zdolności adhezyjnej do Caco-2 komórek, odporności na pH 2,5, kwasy żółciowe, antymikrobiologiczną aktywność i inhibicję S. typhimurium. W badaniach tych stwierdzono również, że L. acidophilus CYC 10051 i L. kefiranofaciens CYC 10058 charakteryzują się silnymi właściwościami probiotycznymi.
Marquina i wsp. [22] stwierdzili, że przy konsumpcji kefiru wzrasta, w jelicie mysz, populacja bakterii kwasu mlekowego oraz obniża się liczba Enterobacteriaceae i Clostridia. Kakisu i wsp. [15] podają, że wprowadzenie 5% grzybków kefirowych do przewodu pokarmowego mysz, może zapobiec wzrostowi Bacillus cereus. Natomiast 1% jest zbyt mały i nie pozwala na uzyskanie podobnych efektów. Medrano i wsp. [23] stwierdzili, że spożywanie kefiran ochrania komórki Caco-2 przed uszkodzeniem przez Bacillus cereus B 10502, kiedy wprowadzamy je w formie skoncentrowanej w granicach 300 do 1000 mg/l. Badania te dowiodły także, że aktywność dehydrogenazy mitochondrialnej w badaniach testowych komórek, była wyższa w obecności kefiran. Wyniki badań mikroskopowych wskazują również, że kefirany zapobiegają uszkodzeniu strukturalnemu komórek organizmu przez B. cereus.
Rodrigues i wsp. [30] badali wpływ kefiru na gojenie się tkanki skórnej u szczurów rasy Wistar, po wprowadzeniu podskórnie 0,1 ml komórek Staphylococcus aureus. W tych badaniach populacja zwierząt z podawanym NaCl stanowiła kontrolną grupę negatywną, z neomycyną pozytywną, a skrzep kefiru nakładano miejscowo na rany. Kontynuując nakładanie kefiru przez 7 dni, stwierdzono wyraźną lepszą poprawę gojenia ran niż w grupie kontrolnej pozytywnej z neomycyną.
W dalszych badaniach stwierdzono, że dieta z Lactobacillus stymuluje u zwierząt system odpornościowy [27]. Toreuux i Schmucker [37] podają, że przy konsumpcji kefiru wzrasta w przewodzie pokarmowym, młodych i dorosłych szczurów, specyficzny system odporny na toksynę cholery.
Jednakże równoległe wyniki tych badań nie były tak jednoznaczne. Kefir spożywany w BALB/c przez samice mysz moduluje skład mikroflory jelitowej i system odpornościowy, (następuje wzrost IgA+ i IgG+), co potwierdza, że produkt ten zawiera różne bakterie, zdolne do życia i aktywności mikrobiologicznej w zmiennych warunkach przewodu pokarmowego, podobnie jak ma to miejsce w zróżnicowanej odporności na cieplną inaktywację.
Vinderola i wsp. [40] potwierdzili, że kefir zawierając zdolne do życia w przewodzie pokarmowym bakterie, wzmacnia równocześnie jego system odpornościowy (np. kefir stymuluje aktywność fagocytów i makrofagów płuc). Z dalszych prac tych autorów (dotyczących immunomodulacji pojemności kefiran produkowanych przez L. kefiranofaciens) wynika, że doustne podawanie kefiran (100 mg/kg) przez 7 dni prowadzi do wzrostu IgA+ i stanowi konkurencję dla niewielkiego wzrostu komorek IL-4, IL-6, IL-10+ i IL-6+.
Cogan i wsp. [3] wykazali obecność w kefirze różnych typów bakteriocyn. Dla przykładu, z trzech typów znanych bacteriocin produkowanych przez laktokoki, pierwszy hamuje szczepy tylko tej grupy bakterii, drugi szczepy L. casei, L. helveticus i Pediococcus pentosaceus, a trzeci szerokie spektrum szczepów Lactococcus, Leuconostoc, Pediococcus, S. thermophilus i Staphylococcus aureus. Mikroflora kefirowa może wytwarzać również znane substancje o działaniu antywirusowym, np. interferony, białka antywirusowe, co jest także bardzo korzystne dla zdrowia ludzkiego [6].
Nietolerancja laktozy
Istotnym problemem globalnym jest nietolerancja laktozy u ludzi związana z niedostateczną aktywnością β-galaktozydazy. Przy braku aktywności tego enzymu, laktoza pozostaje w przewodzie pokarmowym i staje się pożywką dla bakterii coli. Prowadzi to najczęściej do wytworzenia dwutlenku węgla i w konsekwencji powstania różnych dolegliwości przewodu pokarmowego. Podczas fermentacji mlekowej zawartość laktozy w mleku ulega obniżeniu. De Viese i wsp. [5] badając wpływ konsumpcji kefiru na strawność laktozy wykazali u zwierząt spożywających kefir, wzrost zawartości galaktozy o około 30%. Zdaniem Hertzler i Clancy [11] podawanie dorosłym w diecie kefiran wpływa wyraźnie na poprawę strawności laktozy. Zdaniem autorów konsumpcja kefiru obniża również o około 71% uporczywość wzdęć.
prof. dr hab. Zdzisław Żbikowski
Katedra Mleczarstwa i Zarządzania Jakością
Uniwersytet Warmińsko Mazurski w Olsztynie
Literatura
1. Cenesiz S., et al., 2008, Deut. Tierarztl. Woch., 115, 15-19.
2. Cevikbas A., et al., 1994, Phytother. Res., 8, 78-82.
3. Cogan T., et al., 1997, J. Dairy Res., 64, 409-421.
4. De Moreno de LeBlanc A., et al., 2006, J. Dairy Sci., 90, 1920-1928.
5. De Viese M., et al., 1992, Br. J. Nutr., 67, 67-75.
6. Farnoworth R., 2003, Handbook of Fermented Functional Foods. Boca Raton,
CRC Press.
7. Guven A., et al., 2003, J. Vet. Med., B 50, 412-416.
8. Guzel-Seydim Z., et al., 2000b, J. Dairy Sci., 83, 275-277.
9. Guzel-Seydim Z., et al., 2006, Int. J. Dairy Technol., 59, 209-215.
10. Guzel-Seydim Z., et al., 2011, Crit. Rev. in Food Sci. Nutr., 51, 261-268.
11. Hertzler S., Clancy S., 2003, J. Am. Diet. Assoc., 103, 582-587.
12. Hlastan-Ribić C., et al., 2005, Nutr. Res., 25, 55-63.
13. Hosoda M., et al., 1992, J. Dairy Sci., 75, 976-981.
14. Ip C., et al., 1994, Cancer Res., 54, 1212-1215.
15. Kakisu E., et al., 2007, J. Food Protec., 70, 2613-2616.
16. Kiessling G., et al., 2002, Eur. J. Clin. Nutr., 56, 843-849.
17. Kołakowski P., Pawlikowska K., 2012, Milchwiss., 67, 2, 159-162.
18. Liu J., et al., 2002, Nutr. Cancer, 44, 183-187.
19. Liu J., et al., 2005, J. Agric. Food Chem., 53, 2467-2474.
20. Liu J., et al., 2006, Brit. J. Nutr., 95, 939-946.
21. Mc Intosh G., et al., 1995, J. Nutr., 125, 809-816.
22. Marquina D., et al., 2002, Lett. Appl. Microbiol., 35, 136-140.
23. Medrano M., et al., 2008, Int. J. Food Microbiol., 122, 1-2.
24. Moller N., et al., 2008, Eur. J. Nutr., 47, 171-182.
25. Nadathur S., et al., 1995, Mut. Res., 334, 213-224.
26. Parvez S., et al., 2006, J. Appl. Microbiol., 100, 1171-1182.
27. Perdigon G., et al., 1986, J. Food Prot., 49, 986-989.
28. Powell J., et al., 2007, Int. Dairy J., 17, 190-198.
29. Quirós A., et al., 2005, J. Dairy Sci., 88, 3480-3487.
30. Rodrigues K., et al., 2005, Int. J. Antimicrob. Ag., 25, 404-408.
31. Santos A., et al., 2003, Syst. Appl. Microbiol., 26, 434-437.
32. Shiomi M., et al., 1982, Jpn. J. Med. Sci. Biol., 35, 75-80.
33. Sozmen M., et al., 2005, Scand. J. Lab. Anim., 32, 211-220.
34. Stidl R., et al., 2008, Mol. Nutr. Food Res., 52, 322-329.
35. St-Onge M., et al., 2002, BMC Complement. Alter Medicine, 2, 1-789.
36. Taylor C., et al., 2009, Nutr. Rev., 67, 398-415.
37. Thoreux K., Schmucker D., 2001, J. Nutr., 131, 807-812.
38. Ulusoy B., et al., 2007, Turkish Microbiol. Soc., 37, 103-107.
39. Urdaneta E., et al., 2007, Nutr. Rev., 27, 653-658.
40. Vinderola C., et al., 2005, J. Dairy Res., 72, 195-202.
41. Vinderola C., et al., 2006, J. Dairy Res., 73, 472-479.
42. Vujicić I., et al., 1992, Biotechnol. Lett., 14, 847-850.
43. Xiao J., et al., 2003, J. dairy Sci., 86, 2452-2461.
44. Yoon Y., et al., 1999, Korean J. Animal Sci., 41, 39-44.
45. Yoshida Y., et al., 2005, Biosci. Biotechnol. Biochem., 69, 4, 714-723.
















