Przegląd Mleczarski 8/2024 - Rutyna doju jako czynnik poprawiający opłacalność produkcji mleka

Rutyna doju jest elementem potrzebnym dla pozyskania wysokiej jakości surowca pochodzenia zwierzęcego, którym jest mleko krowie. Aspekt ten jest szczególnie istotny w hodowli wysokowydajnych krów mlecznych, głównie rasy holsztyńsko-fryzyjskiej (HF). Dobór chemii do przed- i poudojowej dezynfekcji, produktów do mycia i dezynfekcji dojarek, prawidłowe ich stosowanie czy schemat postępowania w przygotowaniu do doju, to tylko niektóre czynniki warte uwagi hodowców.
Dobra rutyna to mniej nowych infekcjiMastitis nadal jest główną przyczyną zmniejszenia zysków hodowców bydła mlecznego z powodu obniżonej jakości technologicznej i wydajności dziennej, a także odsetka zwierząt brakowanych [9].
Szybka intensyfikacja produkcji mleczarskiej w ciągu ostatnich 20 lat zaowocowała centralizacją produkcji, tzn. zauważalny jest trend zmniejszania się liczby gospodarstw, przy jednoczesnym wzroście liczby krów w stadzie. Jednocześnie nastąpił rozwój mechanizacji produkcji zarówno w automatyzacji systemów udojowych, ale także innowacyjnych rozwiązań usprawniających zarządzanie czy żywienie krów mlecznych [2]. Równolegle zmieniło się podejście do zarządzania mastitis w nowoczesnych oborach, czego efektem jest zwykle wdrożenie ścisłych procedur (rutyna doju), ale także bardziej rygorystycznych kryteriów higienicznych dla stosowanych produktów do dezynfekcji wymienia i pomieszczeń inwentarskich.
Prowadzona selekcja wśród rasy HF, transformacja technologiczna i wykazanie korzyści wynikających z popularyzacji systemu uwięziowego na rzecz obór wolnostanowiskowych, niewątpliwie wpłynęły na podstawowy skład chemiczny mleka, frekwencje i skład gatunkowych mikroorganizmów bytujących w stadach czy przydatność surowca do dalszego przerobu w przemyśle mleczarskim. Niedawne badania przeprowadzone przez Priyashantha i in. [7] wykazały silny wpływ czynników związanych indywidualnie z gospodarstwem mlecznym (np. system utrzymania i doju, rasa) na cechy jakościowe mleka zbiornikowego. Niewiele jest jednak doniesień koncentrujących się na czynnikach produkcyjnych czy środowiskowych w kontekście mikrobioty mleka zbiornikowego.
W niedawno przeprowadzonych w Szwecji badaniach wykazano, że stosowany schemat przygotowania strzyków przed udojem skutkuje znaczącymi różnicami w mikrobiocie mleka zbiornikowego [12]. Różnice te były szczególnie wyraźne pomiędzy stadami z robotami udojowymi (AMS) a oborami uwięziowymi. Nie miały one jednak stałego charakteru, co dodatkowo sugeruje znaczącą zmienność mikrobioty i może mieć także związek z systemem zarządzania stadem, różnicami w rozwiązaniach oferowanych przez producentów robotów czy zmienną rutynę doju w oborach uwięziowych. Jednocześnie frekwencja izolowanych patogenów z mleka zbiornikowego odzwierciedlała wszelkie zaburzenia, czynności wykonywane przez obsługę czy zdarzenia zachodzące w trakcie przygotowania krów do doju. Sterowanie czy modyfikacje mikrobioty mleka zbiornikowego jest skomplikowane. Trudno ją przewidzieć, ale odpowiednie modyfikacje procedur związanych z przygotowaniem strzyków, stosowaniem postdippingu czy dokładność i systematyczność w czyszczeniu sprzętu udojowego, niezależnie od rodzaju systemu udojowego stada, pozwalała do pewnego stopnia wpłynąć na mikrobiotę mleka zbiornikowego [12]. W związku z tym badacze wykazali zasadność, m.in. dezynfekcji kwasem nadoctowym, stosowania przemiennego kwasów i zasad w celu utrzymania czystości systemu udojowego czy aplikacji preparatów do higieny przedudojowej zamiast wody do czyszczenia wymienia. Informacje te są zgodne z dostępną wcześniej literaturą. Środki higieny w połączeniu ze stosowaniem rutyny doju i skutecznym czyszczeniem sprzętu udojowego zostały zidentyfikowane jako ważne czynniki w określaniu równowagi między populacjami bakterii w mleku zbiorczym [5, 14].
Dostępne są również wyniki badań udowadniające, dodatnie korelacje łączące szczepy występujące w środowisku bytowania krów (obora, hala udojowa) z frekwencją patogenów w mleku zbiornikowym [13]. Z drugiej strony bakterie ważne z technologicznego punktu widzenia, takie jak pałeczki kwasu mlekowego, rzadko występowały w środowisku obory, ale były identyfikowane w mleku i na powierzchni skóry strzyków [13]. Monsallier i in.z [6] wykazali, że skóra strzyków to ważne źródło bakterii o znaczeniu technologicznym w produkcji sera i stwierdzili, że wyższa liczba Lactobacillus spp. i Enterococcus spp. była związana z dietą krów bazującą na kiszonkach, wolnostanowiskowymi systemami utrzymania, systemem ściółkowym i umiarkowaną higieną doju.
Oczywisty jest fakt, że mikrobiota mleka zbiorczego jest bardzo zróżnicowana pod względem liczby mikroorganizmów, a wpływają na to także różne i często trudno identyfikowalne czynniki [8]. Kluczowe jest jednak minimalizowanie liczby szczepów powodujących psucie się surowca. Przechowywanie mleka w niskiej temperaturze ok. 4°C, zarówno w gospodarstwie, jak i w zakładzie przetwórczym, chroni surowiec przed nadmiernym rozwojem psychrotrofów, takich jak Pseudomonas spp. [3]. Ich obecność zwiększa ryzyko proteolitycznego lub lipolitycznego psucia się produktów mlecznych, spowodowanego przez enzymy odporne na ciepło [1, 11]. Większość mikroorganizmów ginie w procesie pasteryzacji mleka, ale przetrwalniki i niektóre bakterie odporne na ciepło mogą przetrwać, czego konsekwencją może być właśnie psucie się produktów mlecznych podczas przetwarzania surowca i przechowywania gotowych produktów (np. tzw. „wybuchające sery”). Bakterie kwasu mlekowego w mleku surowym nie namnażają się w temperaturach chłodniczych i generalnie nie uważa się, aby przetrwały pasteryzację w dużych ilościach. Jednakże, po obróbce cieplnej wykazano, że niektóre bakterie kwasu mlekowego, niebędące bakteriami startowymi, są w stanie przetrwać proces obróbki termicznej [8]. Uważa się, że bakterie te dostają się do sera w wyniku obróbki i przetwarzania mleka w zakładzie przetwórczym, ale sugeruje się również, że także surowe mleko może być ich ważnym źródłem [13].
Niektóre badania sugerują, że różnice w wielkości stada przyczyniają się do obserwowanych różnic w różnorodności drobnoustrojów między próbkami mleka zbiorczego z gospodarstw [10]. Oznacza to, że duże fermy wielkotowarowe z nowoczesnymi halami czy AMS mogą charakteryzować się wyższym zróżnicowaniem mikroorganizmów niż małe obory uwięziowe. Dodatkowo badacze wskazują, że zjawisko to jest związane w dużych stadach ze zmiennością osobniczą. Biorąc pod uwagę, że pierwszym źródłem skażenia bakteryjnego w mleku jest pojedyncza krowa, gospodarstwa z większą liczbą krów mogą więc wykazywać większą różnorodność drobnoustrojów w mleku zbiornikowym. W doświadczeniu Sun i in., [12] zaobserwowano także w gospodarstwach AMS różnorodność drobnoustrojów w mleku zbiorczym traktując producenta robotów udojowych jako kolejny czynnik. Przykładowo, mleko z gospodarstw biorących udział w badaniach i korzystających z robotów marki A (strzyki przygotowane w kubkach do mycia letnią wodą, suszone przez strumień powietrza) charakteryzowało większe bogactwo gatunkowe mikroorganizmów w mleku zbiorczym niż mleko z gospodarstw korzystających z robotów marki B (2 szczotki oczyszczające strzyki). Po doju stada korzystające z robotów marki A stosowały dipping w sprayu na bazie jodu, podobnie jak około połowa ferm z robotami marki B. Pozostali hodowcy stosowali dipping w sprayu na bazie kwasu mlekowego lub nie stosowali żadnego środka. Mleko z gospodarstw o uwięziowym systemie utrzymania wiązało się z niższą całkowitą liczbą drobnoustrojów (TBC) i wyższym poziomem bakterii Pseudomonas spp, w porównaniu do gospodarstw AMS. W przeciwieństwie do gospodarstw AMS, w gospodarstwach uwięziowych bardziej zróżnicowana mikrobiota związana była prawdopodobnie z niższym TBC, ze względu na stosowanie środków do przedudojowej dezynfekcji strzyków i częstszym stosowaniem mycia sprzętu udojowego kwasem. Jednym z wyjaśnień może być to, że wyższe TBC w mleku z gospodarstw, w których rzadziej stosowano mycie kwasem i nie stosowano środków chemicznych do przygotowania strzyków, było związane z kilkoma dominującymi rodzajami bakterii, w tym Bacillaceae, Enterobacteriaceae i Acinetobacter, przyczyniając się do niższego bogactwa gatunkowego.
Dobieraj chemię do potrzeb
Wymagania dotyczące środków do dezynfekcji strzyków dla mleczarni, obejmują zapobieganie nowym infekcjom gruczołu mlekowego u krów, brak podrażnień dla zwierząt i ludzi, udowodnioną skuteczność bakteriobójczą, promowanie gojenia się zmian i kondycji strzyków oraz brak pozostałości środka dezynfekującego, który może mieć wpływ na zdrowie ludzi. W Polsce organem odpowiedzialnym za rejestrację produktów o właściwościach przeciwdrobnoustrojowych na rynek krajowy i europejski jest Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Na stronie urzędu znajduje się Wykaz Produktów Biobójczych aktualizowany min. 2 razy w roku. Wyróżnikiem dla produktów z listy jest 8% VAT, dzięki czemu hodowca może szybo zweryfikować używane w stadzie środki. Hodowcy, którzy chcą mieć pewność, że używają dobrej chemii, mogą więc w pierwszej kolejności sprawdzić interesujące ich produkty w wykazie. Dodatkową weryfikacją mogą być np. mikrobiologiczne analizy czystościowe próbek pobranych w czasie doju, np. z kubków z dippingiem, pianą czy aparatów udojowych po dezynfekcji. Jedynym akceptowalnym wynikiem dla dippingów jest brak wzrostu patogenów, a dla preparatów przedudojowych nieliczny wzrost kolonii. Prawidłowe pobranie próbki jest jednak kluczowe, gdyż czynnikiem zaburzającym prawidłową analizę może być np. dostanie się wody do kubka z dippingiem.
Równie szerokim zagadnieniem jest wybór substancji aktywnej w preparatach do przed- i poudojowej dezynfekcji. Najbardziej popularne są produkty bazujące na kwasie mlekowym, chlorheksydynie, jodzie i dwutlenku chloru. W stadach mających problemy z somatyką dobrym rozwiązaniem jest wdrożenie środków z silniejszą substancją aktywną. Szczególnie takim rozwiązaniem powinny być dwuskładnikowe produkty na bazie dwutlenku chloru. W przypadku złej kondycji strzyków warto np. na miesiąc wdrożyć preparaty z chlorheksydyną, mającą pozytywny wpływ na skórę strzyków.
Rutyna doju
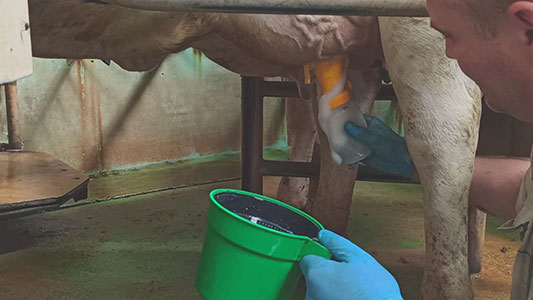
W praktyce rutyna doju powinna byś opracowana indywidualnie dla każdego stada z uwzględnieniem takich czynników jak, np. system doju, wielkość hali udojowej, liczba dojarzy, frekwencja patogenów w stadzie czy warunki środowiskowe. Przyjmuje się jednak, że obowiązkowy powinien być etap przedzdajania do kubka. Zdajanie strug na powierzchnię hali może przyczynić się do szybszego transferu patogenów, głównie zakaźnych np. S. aureus czy Prototheca spp. Pierwsze 10-12 strug mleka może być przydatne w jego wizualnej ocenie. Obecność kłaczków w pierwszych 2-4 strugach nie powinna niepokoić, ale jeśli występują one > 10 strug, to powinna zostać wykonana analiza TOK w celu określenia stopnia zaawansowania potencjalnej infekcji. Wynik ++ lub +++ (silne żelowanie) powinien być równoznaczny z pobraniem próbki mleka do badań. Ewentualnym zabiegiem dodatkowym przed wynikami antybiogramu może być zastosowanie maści czy bezkarencyjnej tuby.
Fotografia 1. Przedzdajanie pierwszych strug mleka przed dojem

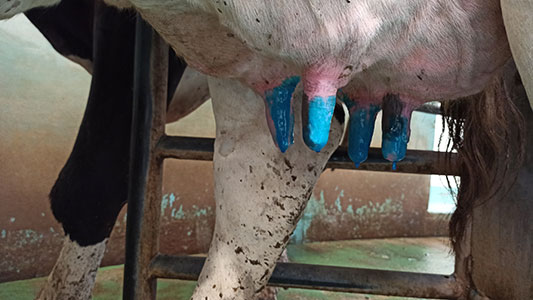
Przedzdajanie można wykonać przed aplikacją piany lub po, wiele zależy od opracowanej rutyny (fot. 1). Piana powinna mieć min. 30-40 sekund kontaktu ze skórą strzyków, a wyjątkowo brudne strzyki warto potraktować pianą dwukrotnie (fot. 2). Oprócz względów higienicznych moment badania wymienia oraz predippingu stymuluje wyrzut oksytocyny po ok 1-1,5 minuty. Dopiero wtedy podłączony powinien zostać aparat udojowy, by nie zwiększać ryzyka doju bimodalnego (pustodój na początku). Po doju kanał strzykowy pozostaje otwarty tym dłużej im starsza jest krowa (min. 20 min), dlatego aplikacja dippingu powinna przebiegać w jak najkrótszym czasie od zdjęcia aparatu udojowego. Żywy kolor dippingu ułatwia również kontrolę równomiernej aplikacji – cały strzyk powinien być pokryty preparatem (fot. 3).
Fotografia 2. Predipping w formie piany aplikowanej na strzyk przed dojem
Fotografia 3. Nieprawidłowa i nierównomierna aplikacja dippingu – preparat powinien być naniesiony od nasady strzyka aż do kanału strzykowego
Podsumowując, rutyna doju to istotny czynnik wpływający na parametry mleka oraz ograniczający odsetek nowych zapaleń wymienia. Prawidłowe przygotowanie krów do doju powinno być poprzedzone stymulacją, umożliwiającą sekrecję oksytocyny, ponieważ w zatoce mlecznej znajduje się 20-30% mleka zgromadzonego w wymieniu w porze doju. Ścisłe przestrzeganie opracowanych indywidualnie dla stada procedur przedudojowych umożliwia także wczesne wykrycie rozwijającego się w wymieniu stanu zapalnego, co wpływa także na ilość zużywanych antybiotyków i opłacalność produkcji.
dr inż. Aleksandra Kalińska
Katedra Hodowli Zwierząt
Szkoła Główna Gospodarstwa Wiejskiego w Warszawie
dr hab. Marcin Gołębiewski (prof. SGGW)
Katedra Hodowli Zwierząt
Szkoła Główna Gospodarstwa Wiejskiego w Warszawie
Literatura
- Andersson R.E., Danielsson G., Hedlund C.B. & Svensson S.G. (1981). Effect of a heat-resistant microbial lipase on flavor of ultra-high-temperature sterilized milk. Journal of Dairy Science, 64(3), 375-379.
- Clay N., Garnett T. & Lorimer J. (2020). Dairy intensification: Drivers, impacts and alternatives. Ambio, 49(1), 35-48.
- De Jonghe V., Coorevits A., Van Hoorde K., Messens W., Van Landschoot A., De Vos P. & Heyndrickx M. (2011). Influence of storage conditions on the growth of Pseudomonas species in refrigerated raw milk. Applied and environmental microbiology, 77(2), 460-470.
- Europejska Agencja Leków – EMA. (2019). Veterinary medicines: Regulatory information. Amsterdam 2019.
- Michel V., Hauwuy A. & Chamba J.F. (2001). La flore microbienne de laits crus de vache: diversité et influence des conditions de production. Le Lait, 81(5), 575-592.
- Monsallier F., Verdier-Metz I., Agabriel C., Martin B. & Montel M.C. (2012). Variability of microbial teat skin flora in relation to farming practices and individual dairy cow characteristics. Dairy science & technology, 3(92), 265-278.
- Priyashantha H., Lundh Å., Höjer A., Bernes G., Nilsson D., Hetta M. & Johansson M. (2021). Composition and properties of bovine milk: A study from dairy farms in northern Sweden; Part I. Effect of dairy farming system. Journal of Dairy Science, 104(8), 8582-8594.
- Quigley L., O'Sullivan O., Stanton C., Beresford T.P., Ross R.P., Fitzgerald G. F. & Cotter P.D. (2013). The complex microbiota of raw milk. FEMS microbiology reviews, 37(5), 664-698.
- Ruegg P.L. (2012). New perspectives in udder health management. Veterinary Clinics: Food Animal Practice, 28(2), 149-163.
- Skeie S.B., Håland M., Thorsen I.M., Narvhus J. & Porcellato D. (2019). Bulk tank raw milk microbiota differs within and between farms: A moving goalpost challenging quality control. Journal of dairy science, 102(3), 1959-1971.
- Stoeckel M., Lidolt M., Stressler T., Fischer L., Wenning M. & Hinrichs J. (2016). Heat stability of indigenous milk plasmin and proteases from Pseudomonas: A challenge in the production of ultra-high temperature milk products. International Dairy Journal, 61, 250-261.
- Sun L., Lundh Å., Höjer A., Bernes G., Nilsson D., Johansson M. & Dicksved J. (2022). Milking system and premilking routines have a strong effect on the microbial community in bulk tank milk. Journal of Dairy Science, 105(1), 123-139.
- Vacheyrou M., Normand A.C., Guyot P., Cassagne C., Piarroux R. & Bouton, Y. (2011). Cultivable microbial communities in raw cow milk and potential transfers from stables of sixteen French farms. International journal of food microbiology, 146(3), 253-262.
- Verdier-Metz I., Michel V., Delbes C. & Montel M.C. (2009). Do milking practices influence the bacterial diversity of raw milk?. Food microbiology, 26(3), 305-310.
















